Muna Soltan, DDS,* Dennis Smiler, DDS, MScD,† Hari S. Prasad, BS, MDT,‡ y Michael D. Rohrer, DDS, MS§
La médula ósea adulta es una fuente rica de células madre que pueden inducirse a someterse a una diferenciación en una variedad de tejidos adultos. El microentorno de la médula ósea consiste predominantemente en células madre hematopoyéticas (HSC), así como en células no hematopoyéticas. Las HSC son inactivas y silentes. Sin embargo, en respuesta a tensiones tales como infección, ejercicio, cirugía o lesión, las células no hematopoyéticas secretan citocinas solubles e insolubles y factores de crecimiento que activan las células hematopoyéticas. Las células hematopoyéticas luego proliferan, manteniendo su capacidad de células madre progenitoras pluripotentes y/o diferenciando en osteoclastos, monocitos, macrófagos, plaquetas, glóbulos rojos y blancos, y otras células sanguíneas.
Las no HSC, que pueden clasificarse aproximadamente como células “estromales”, apoyan y regulan el destino de la hematopoyesis. Las células no hematopoyéticas incluyen los siguientes:
- Células madre mesenquimales (MSC) que producen osteoblastos, adipocitos y fibroblastos.
- Células endoteliales, que funcionan como una barrera permeable entre la cavidad medular y la circulación.
Las células endoteliales recubren la pared vascular especializada de la médula llamada sinusoides. Su estructura es una red esponjosa que da soporte a la médula y separando el endostio del hueso y la médula ósea. Las células especializadas participan en el apoyo de la maduración y el desarrollo de las células hematopoyéticas, como las células sanguíneas que pueden diferenciarse en glóbulos blancos o glóbulos rojos o megacariocitos en plaquetas. También segregan diversos factores de crecimiento, como los factores de crecimiento endoteliales vasculares y los factores de crecimiento derivados de las plaquetas.
En los últimos años, el trasplante in vivo de células madre adultas en aspirado de médula ósea se ha utilizado con éxito para mejorar la regeneración ósea. Las células trasplantadas establecen una matriz ósea inicial sin mineralizar (osteoide) y comienzan el proceso de colocación de hidroxiprapatita, el componente mineral del hueso en la matriz extracelular.
Las reglas para lograr injertos óseos exitosos se discuten en varios artículos. Se ha descrito una técnica simple y efectiva para aspirar la médula ósea de pacientes que se están realizando un injerto en preparación para la colocación del implante.
Para contener el aspirado dentro del injerto de andamio osteoconductor, se han utilizado materiales particulados que reabsorben lentamente, como el aloinjerto óseo no desmineralizado, la matriz de hidroxiapatita reabsorbible y el fosfato tricálcico. Todos los materiales de injerto óseo particulados requieren una estabilización. Esto se puede lograr con membranas de regeneración ósea guiadas y/o una malla de titanio anclada con tornillos para huesos. Los inconvenientes de tales procedimientos son que pueden crear dehiscencias de tejidos blandos y, en última instancia, requieren una extirpación quirúrgica bastante invasiva del injerto, la malla y los tornillos.
Por el contrario, los bloques óseos se pueden asegurar únicamente con tornillos a los que se puede acceder fácilmente para su extracción mediante una pequeña incisión en la región bucal del tejido blando. Para lograr la misma curación acelerada lograda con combinaciones de partículas de hueso y aspirado de médula ósea, los autores han desarrollado una técnica para impregnar un aloinjerto de hueso con aspirado de médula ósea. Este artículo describe el uso de esa técnica en 5 pacientes. De 1 de ellos, se obtuvo y analizó una muestra central del injerto.
MATERIALES Y MÉTODOS
En los 5 pacientes, el sitio receptor se preparó de la siguiente manera. Primero, se realizó una incisión en la cresta alveolar en el espacio edéntulo con un bisturí número 15 o un láser (DEKA Laser Technologies LLC, Ft. Lauderdale, FL). Se crearon incisiones de relajación verticales adyacentes, que se extendieron hacia el vestíbulo y se conectaron a los márgenes laterales de la incisión crestal. Estas incisiones verticales se pueden hacer en los sitios de 1 o más dientes adyacentes al área edéntulo. Un colgajo de base ancha garantiza el flujo de sangre necesario al colgajo y al periostio.
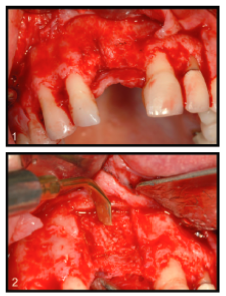
Se tuvo cuidado de preservar el periostio sin rasgarlo, mientras se reflejaba el colgajo (Fig. 1). El sitio del receptor se preparó luego decorando el hueso labial / bucal utilizando un taladro o una sierra de Piezosurgery (Fig. 2) (Piezosurgery, Matawan, NJ) con un accesorio de azada para exponer la cantidad máxima de hueso esponjoso.
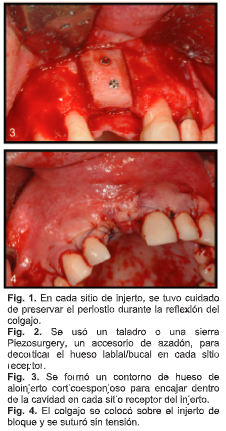
Se formó un contorno de hueso de aloinjerto cortico esponjoso para encajar dentro de la cavidad del sitio del receptor preparada (Fig. 3). Al contornear el bloque óseo, se tuvo cuidado para evitar retirar el componente esponjoso. Todo el contorno del bloque se realizó a expensas del hueso cortical más denso. Esto es importante para permitir que el aspirado de médula ósea sature el compartimento esponjoso.
Una vez instalado en el sitio, el bloque se estabilizó con 1 o 2 tornillos para huesos (Fig. 3). Se usó un molino de huesos para preparar las piezas extraídas del bloque durante el proceso de contorneado.
El colgajo muco perióstico se volvió a colocar y se examinó para determinar la pasividad durante la sutura. Si el cierre primario parecía cuestionable, el periostio no estirado se rellenó alto dentro del colgajo de base ancha para liberar este tejido y asegurar una posición pasiva sin tensión en la incisión suturada.
El bloque óseo se desenroscó y se extrajo del sitio del receptor y se colocó en una jeringa. Luego se aspiraron entre 1 y 4 ml de aspirado de médula ósea de la cresta ilíaca del paciente, como se describió anteriormente por Smiler y Soltan. Este aspirado se colocó en la jeringa que contenía el bloque óseo y se unió el émbolo. El extremo de la jeringa se ocluyó y el émbolo se retiró para crear un vacío e impregnar el compartimento esponjoso del bloque óseo con el aspirado de médula ósea.
El bloque óseo impregnado de médula se colocó nuevamente en el sitio del receptor y se aseguró con tornillos para huesos. Las partículas de aloinjerto preparadas se saturaron con el aspirado restante y se embutieron alrededor y sobre el injerto. El colgajo muco perióstico se volvió a colocar y se suturó sin tensión en el sitio de la incisión (Fig. 4).
Los detalles de los 5 pacientes tratados fueron los siguientes:
Caso 1
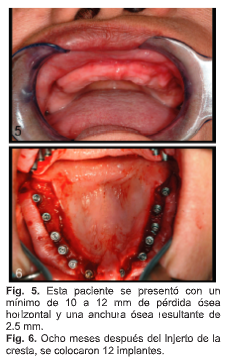
AM, una mujer de 53 años de edad, que se presentó con reabsorción severa bilateral del maxilar posterior y anterior. En el maxilar anterior, la papila incisiva estaba en el punto medio, lo que sugiere un mínimo de 10 a 12 mm de pérdida de hueso horizontal y una anchura ósea resultante de 2.5 mm (Fig. 5). Dos bloques óseos de aloinjerto (Musculoskeletal Transplant Foundation, banco de tejidos de la universidad de Michigan, Michigan) para adaptarse al sitio receptor maxilar anterior decorticado, se saturaron con aspirado de médula ósea y se estabilizaron con 2 tornillos óseos cada uno (ACE Bone Screws, ACE surgical Supply Company, Inc., Brockton, MA). El maxilar posterior derecho e izquierdo se prepararon para el aumento subántrico de elevación del seno y se injertaron con PepGen P-15 (Dentsply-CeraMed-Dental, Lakewood, CO) mezclado con aspirado de médula ósea. Después de 8 meses de cicatrización, se colocaron 12 implantes Xive (Dentsply Friadent) (Fig. 6). Los implantes están todos integrados y soportan una prótesis fija de corona y puente.
Caso 2
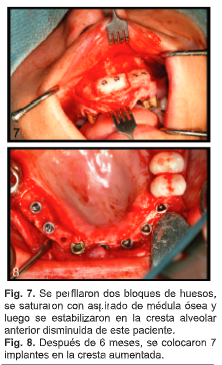
S.H., una mujer de 41 años presentaba una cresta alveolar disminuida del maxilar anterior que se extendía desde el segundo molar derecho hasta los dientes de la izquierda. Se perforaron múltiples orificios en la región bucal del sitio del receptor de injerto óseo para decorticar el compartimento esponjoso disminuido, y se creó una cavidad. Después de que 2 bloques de huesos (ACE Surgical Supply, Salt Lake City, UT) se perfilaron y se saturaron con aspirado de médula ósea, se estabilizaron en el sitio del receptor con tornillos (Fig. 7) y se dejaron curar durante 6 meses. Luego se colocaron siete implantes Nobel Replace Tapered Groovy (Nobel Biocare, Yorba Linda, CA) (Fig. 8). Todos los implantes se han integrado y admiten una restauración de coronas y puentes fijos.
Caso 3
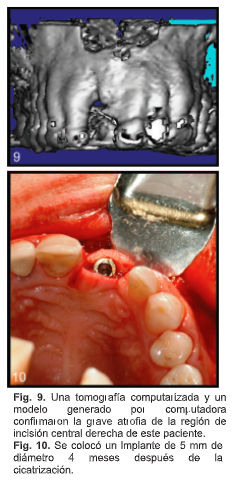
M.B., un hombre de 44 años se presentó con atrofia severa de la región incisiva central derecha después de múltiples intentos fallidos de injerto de hueso autógeno. Una tomografía computarizada y un modelo generado por computadora confirmaron la extensión de la pérdida ósea (Fig. 9). Se preparó un bloque óseo de aloinjerto (ACE Surgical Supply) y se colocó como se describe anteriormente. A los 4 meses, hubo una curación completa del injerto en el sitio del receptor. Se creó una osteotomía del implante y se colocó un implante Replace Speedy de 5 mm de diámetro (Nobel Biocare) (Fig. 10). Se ha logrado un éxito de osteointegración y ahora admite una restauración de una sola corona.
Caso 4
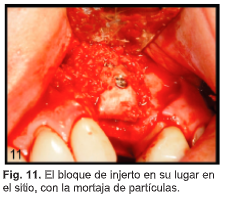
N.G., una mujer de 48 años de edad requirió el aumento del primer sitio bicúspide izquierdo edéntulo antes de la extracción del segundo bicúspide y la colocación de 2 implantes. Se utilizó una fresa de fisura para decorticar el hueso bucal en el sitio receptor, exponiendo el compartimento esponjoso. Se saturó un trozo de aloinjerto de bloque AlloOss (ACE Surgical Supply) con aspirado de médula ósea, se estabilizó con tornillos para huesos y se colocaron partículas sobre el injerto (Fig. 11). Después de 7 meses de cicatrización se colocó un implante. El implante se integró y soporta una restauración fija.
Caso 5
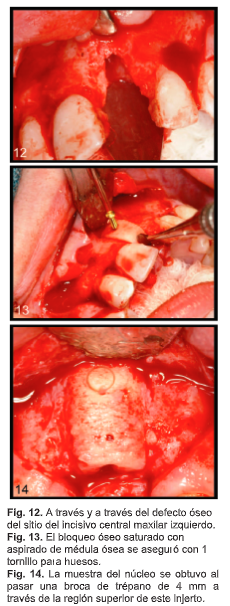
J.B., una mujer de 22 años presentaba un defecto óseo a través del sitio del incisivo central superior izquierdo (fig. 12). Después de remover piezosúrgicamente el hueso cortical para acceder al suministro de sangre, se preparó una cavidad rectangular dentro del compartimento esponjoso en el sitio del receptor. Un bloque óseo AlloOss saturado con aspirado de médula ósea se colocó y aseguró con 1 tornillo para huesos (Fig. 13). El colgajo muco perióstico se volvió a colocar y se suturó sin tensión, y después de la cicatrización se colocó un único implante Nobel Biocare Speedy. Este actualmente soporta una restauración de corona provisional exitosa.
La tabla 1 resume los 5 casos tratados con bloqueo óseo de aloinjerto y aspirado de médula ósea.
Procedimiento de biopsia
Cuatro meses después de la cirugía de colocación del implante, se obtuvo una muestra de núcleo de 4 mm de diámetro al pasar un taladro de trépano de 4 mm a través de la región superior del injerto colocado en el paciente. El caso 3 se seleccionó para mostrar el análisis histomorfométrico del sitio injertado. El paciente tenía un defecto crítico como se ve en la tomografía computarizada (Fig. 9). En el pasado, se intentaron múltiples injertos de hueso autógenos fallidos, con una gran pérdida ósea, poca irrigación sanguínea disponible de la cresta esponjosa residual y el periostio, y una cicatriz de tejido blando gruesa presente en los intentos quirúrgicos anteriores. El periostio en la región bucal es delgado y comprometido al no proporcionar el suministro de sangre, las células madre y los osteoblastos necesarios para la regeneración. Al ser un hombre de 44 años, hay una disminución natural en la circulación de MSC en la sangre periférica que normalmente lleva las células a los sitios quirúrgicos en comparación con los pacientes que son más jóvenes (Fig. 14).
Procesamiento de muestras
La muestra de biopsia se fijó en formalina amortiguada al 10% y se sometió a examen histológico. Después de la deshidratación con una serie graduada de etanol durante 9 días, la muestra se infiltró durante 20 días con una resina de incrustación fotopolimerizable (Technovit 7200 VLC, Kulzer, Wehrheim, Alemania), luego se incluyó en Technovit 7200 VLC y La luz de 450 nm con la temperatura de la muestra no debe superar los 40°C. La muestra se preparó mediante el método de corte y rectificado de Donath15 y se cortó a espesores de 150 mm en un sistema de corte y rectificado EXAKT (EXAKT Technologies, Oklahoma City, OK), y luego montado en laminillas. Cada laminilla de espécimen fue pulida hasta un espesor de 55 μm con una serie de discos de pulido de arena de 800 a 2400 granos (sistema de micromolido EXAKT) seguido de un pulido final con una pasta de pulido lumina de 0.3 µm. Después del pulido final, las laminillas de muestra se tiñeron con picro fucsina de Stevenel azul y van Gieson y se sometieron a evaluación histológica mediante microscopía óptica. La muestra se evaluó utilizando 2 portaobjetos para evitar el sesgo de muestreo.
Las microfotografías se obtuvieron, escanearon, digitalizaron y analizaron utilizando un fotomicroscopio Zeiss Axiolab (Carl Zeiss, Jena, Alemania) y una cámara digital Nikk Coolpix 4500 (Nikon Corp, Tokio, Japón). Todas las muestras de núcleo se fotografiaron en un punto focal fijo y una magnificación de ×25 para la evaluación histomorfométria. Las mediciones histomorfométricas se completaron con una computadora Macintosh G4 (Apple, Cupertino, CA) y un programa de imágenes de dominio público (NIH Images, US National Institutes of Health) junto con Adobe Photoshop (Adobe, San Jose, CA). Los datos se exportaron a Microsoft Excel (Microsoft Co., Redmond, WA) para realizar cálculos histomorfométricos. Se realizó un análisis histomorfométrico y los siguientes parámetros se midieron en términos del porcentaje del área central total: formación de hueso nuevo, material de injerto residual y espacio medular.
RESULTADOS
Después de 4 a 8 meses de curación, todos los injertos se habían integrado en el hueso receptor. Los implantes se colocaron en los 5 sitios y se osteointegraron con éxito. El examen del núcleo óseo para el caso 3 después de 4 meses mostró que el injerto estaba bien integrado, con un 54% del núcleo formado por hueso y un 46% de médula. El ochenta y nueve por ciento del hueso era vital. Este paciente ha tenido múltiples procedimientos de injerto óseo con hueso autógeno que fracasaron y terminó con un gran defecto crítico, como se ve en la Figura 9.

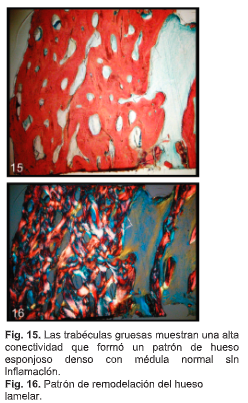
Histología e histomorfometría
La muestra del núcleo estaba compuesta de hueso esponjoso muy denso. Las trabéculas gruesas que muestran una alta conectividad formaron un denso patrón de hueso esponjoso con médula ósea normal no inflamada (Fig. 15). La muestra exhibe algún patrón de organización lamelar con mayor presencia osteoblástica y su secreción de matriz osteoide. A medida que madura, se vuelve más calcificada y organizada, los osteoblastos quedan atrapados en su secreción y se convierten en osteocitos. Los osteocitos de cada célula ósea madura ocupan un espacio llamado laguna. A medida que el hueso madura, hay menos osteocitos por unidad de área, como se ve en algunas áreas del portaobjetos. Una imagen polarizada muestra el patrón de remodelación del hueso laminar (Fig. 16). Unos pocos fragmentos de aloinjerto corticoesponjosos estaban presentes en 1 área aislada del núcleo. Se observó algo de aloinjerto corticoesponjoso con nueva formación ósea íntimamente unida.El análisis histomorfométrico reveló un núcleo muy sólido con 54% de hueso y 46% de médula. El ochenta y nueve por ciento del hueso era vital; el 11% fue aloinjerto no vital.
DISCUSIÓN
¿Qué determina el potencial de cicatrización de heridas de un tejido lesionado? A lo largo de nuestras vidas sufrimos lesiones por accidentes y cirugías de las que nos recuperamos. Esto se debe al proceso de cicatrización de heridas y al notable potencial del cuerpo para repararse a sí mismo. La cicatrización y reparación de heridas involucran el reclutamiento y la proliferación de células capaces de restaurar los tejidos a su forma y función original. Los estudios muestran la participación de la médula ósea en la cicatrización después de una lesión, sangrado o enfermedad. El aumento de la actividad de la médula ósea se ha documentado, por ejemplo, en sitios adyacentes a las fracturas óseas.
Las cirugías para restaurar la forma y función de los tejidos lesionados, enfermos o disfuncionales han pasado de ser principalmente operaciones de resección a, cada vez más, procedimientos regenerativos in vivo. Los estudios muestran que los injertos óseos autógenos se pueden reemplazar por trasplantes de células madre que se combinan con una matriz de andamios biocompatible. Esta combinación repara y/o restablece la forma y función de los tejidos lesionados o atrofiados.
El potencial de las terapias basadas en células para la regeneración ósea es posible debido a los avances en las técnicas, los materiales de injerto y la comprensión de la biología de las células madre adultas como fuente regenerativa de los huesos y otros tejidos. Las células o los tejidos actúan de diversas maneras para restaurar, mantener y mejorar la función. Los mecanismos que pueden mejorar la formación ósea incluyen los siguientes:
- El uso de hueso esponjoso autógeno recolectado.
- Trasplante in vivo de células madre.
- Activación celular in situ mediante factores de crecimiento y citoquinas.
- Implantación de tejido generado in vitro.
- Implantación de células cultivadas expandidas aisladas.
El uso de células madre para tratar diversas enfermedades y reconstruir tejido herido, enfermo o disfuncional se ha convertido en un procedimiento de rutina en muchas prácticas clínicas médicas y dentales. El reto para los dentistas es no solo poder responder las preguntas de los pacientes que sienten curiosidad por los procedimientos restaurativos menos invasivos y más predecibles, sino también estar familiarizado con la amplia gama de opciones disponibles para restaurar la forma y función orales de los pacientes. Además de los 5 mecanismos enumerados anteriormente, los factores que el cirujano debe considerar al ofrecer opciones a los pacientes incluyen los siguientes:
- Las necesidades y peticiones del paciente.
- El tamaño del defecto y el tipo de reconstrucción propuesta.
- La calidad y cantidad de tejidos duros y blandos receptores y la cantidad de suministro de sangre.
- El estado fisiológico del paciente, la condición sistémica, la edad y el suministro de células madre de médula ósea disponibles y viables.
- Métodos y técnicas quirúrgicas para optimizar el andamio de matriz.
La extracción de hueso autógeno de la cresta ilíaca y su colocación en el maxilar o la mandíbula es un procedimiento común para tratar las crestas severamente reabsorbidas. Sin embargo, se ha prestado poca atención a los orígenes de desarrollo del hueso donante extraoral o al (los) sitio (s) del receptor intraoral. Muchos odontólogos asumen que el hueso es hueso. De hecho, el hueso de la cresta ilíaca es una entidad sustancialmente diferente del hueso alveolar, una distinción iluminada por el campo de la embriología.
Dentro de la tercera semana después de la fertilización, el embrión humano desarrolla 3 capas germinales distintas: el ectodermo, el mesodermo y el endodermo. Cada una de estas capas más tarde experimenta una compleja cadena de desarrollo, que se ramifica en la miríada de componentes del cuerpo humano completamente desarrollado.
El hueso de la cresta ilíaca y su médula tienen su origen en células mesodérmicas embrionarias. Estas células dan lugar al mesénquima, un tejido conectivo embrionario vagamente organizado. En contraste, los huesos alveolares (maxilar y mandíbula) se derivan en última instancia del ectodermo. Al comienzo de la cuarta semana después de la fertilización, las células de la cresta neural embrionaria, derivadas del neuroectodermo, migran ventrolateralmente a cada lado del tubo neural. Dan lugar a los arcos branquiales o faríngeos para formar la futura región de cabeza y cuello.
Además de tener orígenes diferentes, los huesos de las crestas alveolar e ilíaca también se forman de diferentes maneras. Los huesos de la mandíbula y el maxilar se desarrollan a través de la osificación intramembranosa. Aunque la mayoría de los expertos coinciden en que la porción central del hueso ilíaco plano grande está formada por osificación intramembranosa, la porción externa (los extremos) parece formarse mediante la osificación endocondral del modelo de hueso cartilaginoso. Es a partir de esta porción externa que las células madre son recolectadas por aspiración con aguja.
Los 2 métodos diferentes de formación ósea también difieren en sus procesos de formación y mineralización. Akintoye et al también han demostrado que las células madre de la médula ósea obtenidas de la cresta ilíaca y el maxilar o mandíbula difieren con respecto al tipo de hueso que forman. Las células madre de la región ilíaca forman un hueso más compacto, con células de médula hematopoyética histológicamente observables y suministro de sangre observable. Las células madre del hueso alveolar se dividen más activamente y necesitan inducción. En contraste, las células ilíacas necesitan factores de crecimiento para diferenciarse en células óseas.
Sorprendentemente, cuando las células de médula ósea de la cresta ilíaca se colocan en la mandíbula o maxilar, forman un hueso que es virtualmente indistinguible del hueso nativo en esa área. La presencia de un entorno hipóxico en el sitio quirúrgico, el cambio en el suministro vascular, la diferencia en la carga funcional10 y los factores de crecimiento locales influyen en la diferenciación de las células madre para reparar los sitios defectuosos. Esto es posible en parte debido a la plasticidad de las MSC contenidas dentro del componente esponjoso del hueso de la cresta ilíaca. Esa plasticidad permite a las MSC diferenciarse en cualquier tipo de tejido independientemente de su origen.
Los injertos óseos del ilion, cuando se colocan en el maxilar o en la mandíbula, a menudo se reabsorben rápidamente. El uso de médula aspirada desde la cresta ilíaca, en combinación con una matriz mineralizada, parece ralentizar o compensar la pérdida de volumen óseo, proporcionando resultados más predecibles.
CONCLUSIÓN
El aspirado de médula ósea es seguro y fácil de recolectar. Su obtención es económica y cumple una serie de funciones en los sitios de injerto óseo. Proporciona células que pueden diferenciarse en células óseas e influye en el tejido en, y adyacente al sitio del receptor, para regenerar las células óseas mediante la activación de la capacidad del cuerpo para formar hueso nuevo. También suministra los factores de crecimiento necesarios tanto para la formación ósea como para la angiogénesis. La técnica aquí descrita, de usar bloques de aloinjerto óseo en combinación con médula ósea aspirada, amplía las opciones disponibles para los clínicos dentales que buscan aumentar el hueso maxilar o mandibular de los pacientes como parte de una estrategia general para la administración oral rehabilitación.
FUENTE
IMPLANT DENTISTRY / VOLUMEN 16, NÚMERO 4 2007
Copyright © Lippincott Williams & Wilkins.

